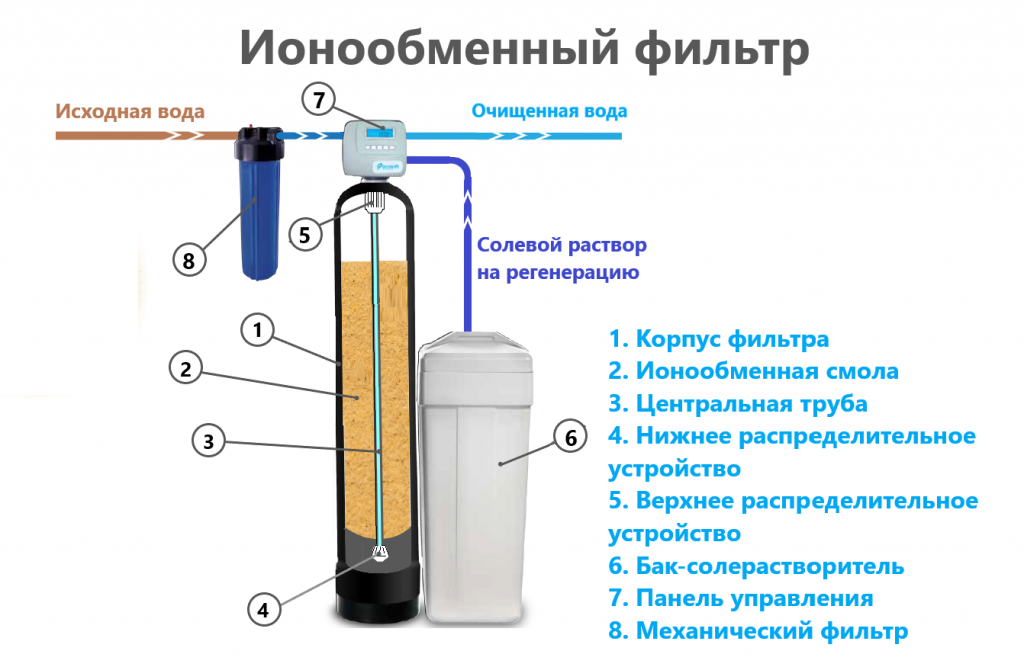
Ссылки [ править ]
- ↑ Редакторы Британской энциклопедии (20 июля 1998 г.). Жесткая вода . Британская энциклопедия . ISBN 9781593392925. Проверено 4 марта 2015 года .
- ↑ Стивен Лоуэр (июль 2007 г.). «Жесткая вода и смягчение воды» . Проверено 8 октября 2007 .
- ^ a b Роу, Гэри (1988). «Загрязнение скважины сбросной водой регенерации умягчителя». Журнал гигиены окружающей среды . 50 (5): 272–276. JSTOR 44541189 .
- ^ a b “Почему я не могу смыть мыло с рук?” . USGS . Дата обращения 7 октября 2019 .
- ^ “Архивная копия” . Архивировано из оригинала на 2011-08-17 . Проверено 16 августа 2011 .
- ^ “Умягчители воды” . Канадская ипотечная и жилищная корпорация. Архивировано из оригинального 10 -го октября 2006 года . Проверено 29 января 2010 .
- ↑ Filtration Facts , сентябрь 2005 г., Управление по охране окружающей среды США, стр. 6-7. По состоянию на 6 января 2013 г.
- ^ «Ионообменная обработка питьевой воды» . Des.nh.gov . 2009 . Проверено 23 июля 2016 .
- ^ «Как добиться оптимальных характеристик смягчителя» . Chem Aqua, Inc. 2020 . Проверено 21 декабря 2020 года .
- ↑ Джером Ковач (26 марта 2007 г.). «Искусство противоточной регенерации» . Журнал «Водоподготовка и очистка» . Проверено 16 февраля 2021 года .
- ^ Ионный обмен против размягчения извести , Nancrede Engineering
- ^ Бартрам, отредактированный Джейми; Балланс, Ричард (1996). Мониторинг качества воды: практическое руководство по разработке и осуществлению программ исследований и мониторинга качества пресной воды (1-е изд.). Лондон: E & FN Spon. ISBN 0419223207.
- ^ Krauter, PW; Harrar, JE; Орлов, ИП; Баховик, С.М. (1 декабря 1996 г.). «Испытание магнитного устройства для уменьшения образования накипи на очистном сооружении D». Osti.gov. ОСТИ 567404 .
- ↑ Рик Эндрю (14 октября 2014 г.). «Новый стандарт оценки оборудования для управления весами» . Журнал «Водоподготовка и очистка» . Проверено 10 февраля 2021 года .
- ^ Тиджинг, Леонард Д .; Пак, Бок Чун; Пэк, Бён Джун; Ли, Дон Хван; Чо, Янг И. (2007). «Экспериментальное исследование механизма объемного осаждения при физической очистке воды для уменьшения загрязнения минералами». Международные коммуникации в тепло- и массообмене . 34 (6): 673–681. DOI10.1016 / j.icheatmasstransfer.2007.03.009 . ISSN 0735-1933 .
- ^ Фокс, Питер (2014). Оценка альтернатив бытовым ионообменным умягчителям воды . Александрия, Вирджиния: Исследовательский фонд WateReuse . ISBN 978-1-941242-00-1. LCCN 2014934179 . Проверено 9 февраля 2021 года .
- ^ Гебауэр, Денис; Фёлькель, Антье; Cölfen, Хельмут (2008). «Стабильные предядерные кластеры карбоната кальция» . Наука . 322 (5909): 1819–1822. DOI10.1126 / science.1164271 . ISSN 0036-8075 .
- ^ “Как работает матрица или кристаллизация с помощью нуклеации?” . FilterSmart. 6 мая 2020 . Проверено 3 марта 2021 года .
- ^ “Salt Home – DHDSP” . Cdc.gov . Проверено 23 июля 2016 .
- ^ Layton, Lyndsey (20 апреля 2010). «FDA планирует ограничить количество соли, разрешенной в обработанных пищевых продуктах, по причинам здоровья» . Washingtonpost.com .
- ^ «Список кандидатов на загрязнение питьевой воды (CCL) и нормативное определение | Агентство по охране окружающей среды США» . Water.epa.gov . 2016-05-09 . Проверено 23 июля 2016 .
- ↑ Перкин, Майкл (18 мая 2016 г.). «Жесткая вода связана с риском экземы у младенцев» .
- ^ «Управление качеством поливной воды» . Государственный университет Орегона . п. 12 . Проверено 4 октября 2012 .
| vтеСоль | |
|---|---|
| История |
|
| Типы |
|
| Использование еды |
|
| Торговля и промышленность |
|
| По регионам |
|
| Культура |
|
| Разное |
|
| Категория |
Можно ли пить воду после ионообменной смолы
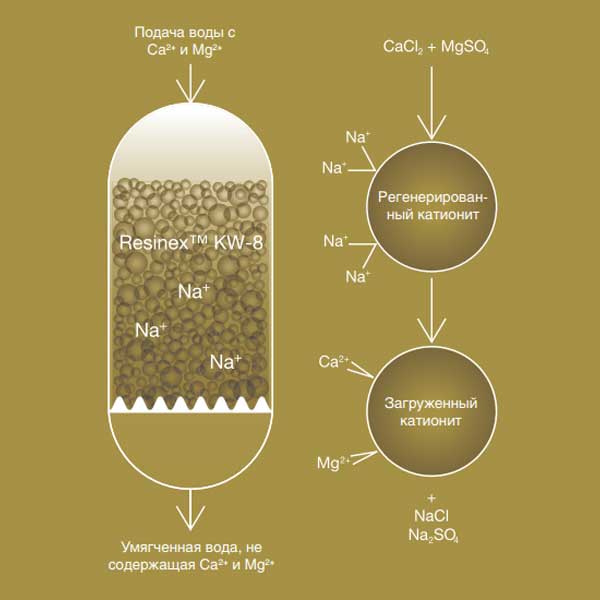
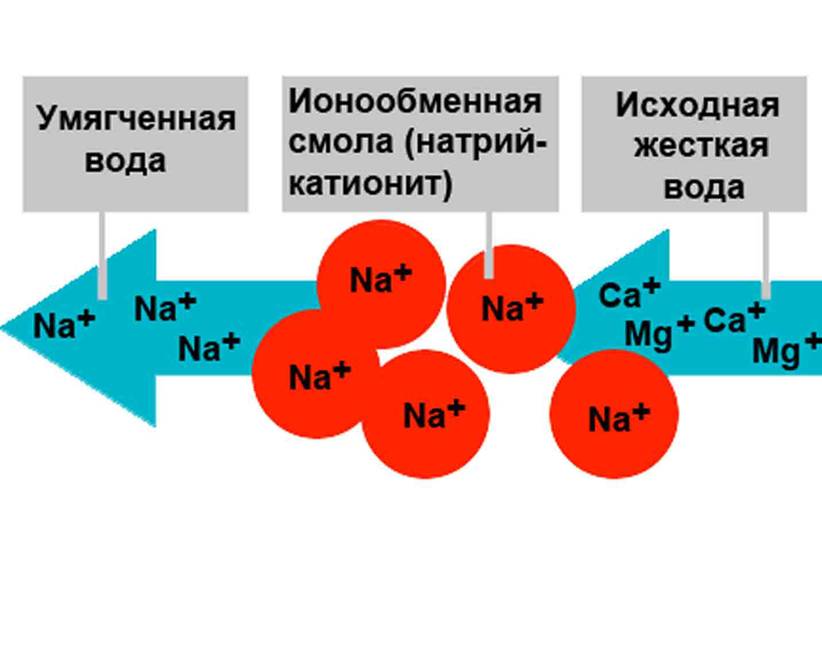
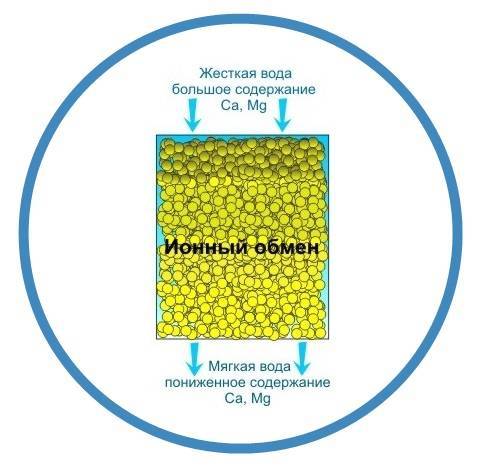
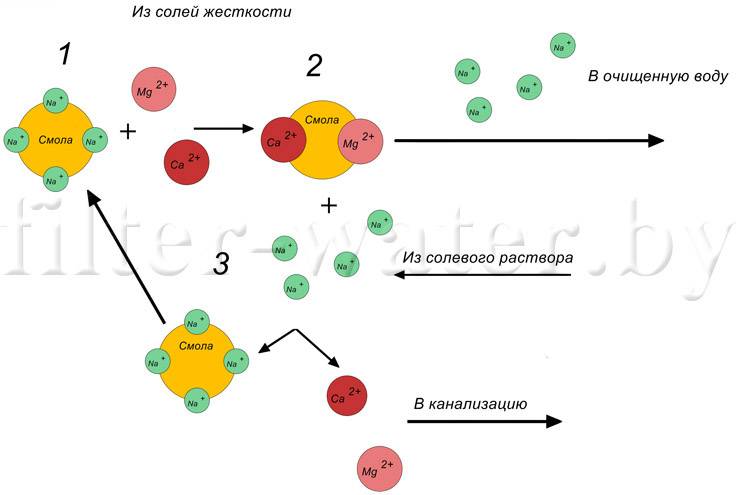
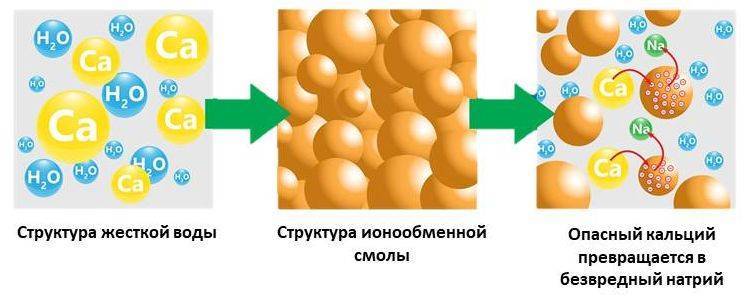
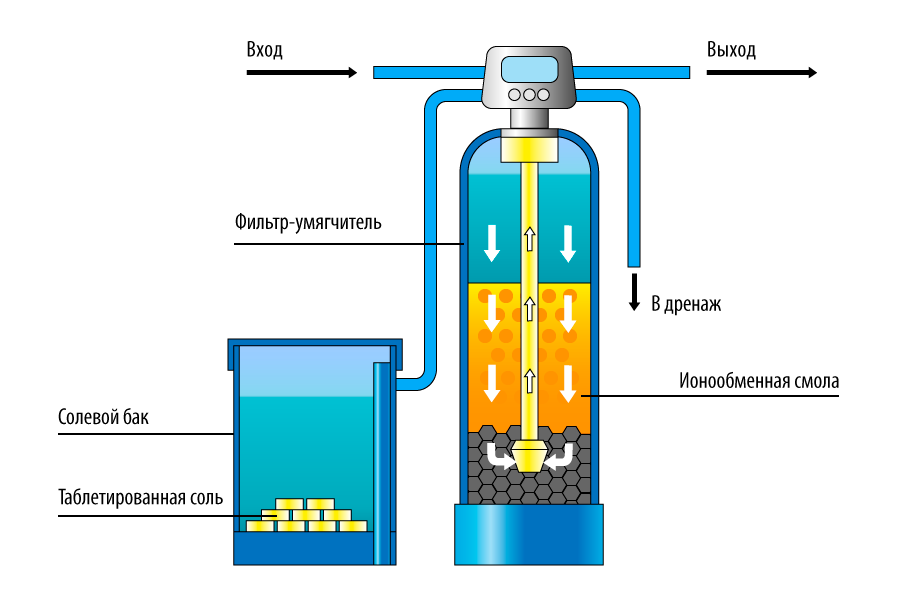
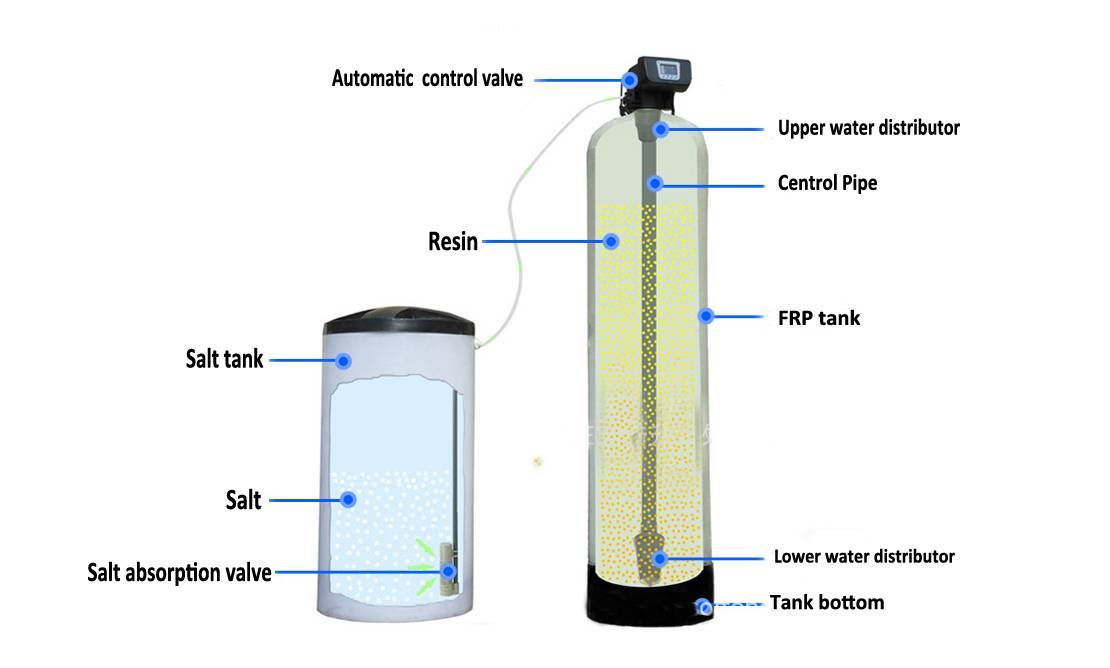
Важно понимать, что основное назначение ионообменных смол – это смягчение воды. В процессе фильтрации происходит замена ионов кальция и магния, способных создавать нерастворимые соединения, на ионы хлора, натрия и другие элементы, которые создают легкорастворимые соединения.
На протяжении всей своей истории человечество вполне успешно училось приспосабливаться к новым природным источникам воды
Различия химического состава жидкости и большое количество этих источников покрывались отличной адаптацией организма человека ко всем внешним факторам.
На протяжении всей своей истории человечество вполне успешно училось приспосабливаться к новым природным источникам воды. Различия химического состава жидкости и большое количество этих источников покрывались отличной адаптацией организма человека ко всем внешним факторам.
Организм сам выводил все «лишнее». Несмотря на большое количество информации о накоплении нерастворимых солей магния и калия в нашем организме и причиняемом ими вреде, каких-либо реальных доказательств этих данных не существует. Это подтверждается еще и тем фактом, что для людей с нарушенными обменными процессами в организме полностью очищенная вода критически опасна. Все необходимые нам элементы относительно здоровый организм способен был извлечь из потребляемой нами воды и пищи.
Но это правило было актуально до всеобщей индустриализации общества, до появления так называемой техногенной среды. Даже природные источники воды в большинстве своем имеют повышенное содержание ионов тяжелых металлов, различные нежелательные органические примеси и даже изотопы радиоактивных элементов. Было бы здорово иметь такой фильтр, который смог бы заменять подобные примеси на ионы естественного происхождения. Но, к сожалению, ионообменные фильтры на такое неспособны.
В большинстве случаев изготовители ионообменных фильтров за счет рекламных слоганов предлагают заменить одни ненужные нам микроэлементы на другие.
Определить, насколько действительно важно менять ионный состав воды с помощью ионообменных фильтров, не так уж и просто. Посмотрите на ситуацию с посудомоечными и стиральными машинами. Для длительной эксплуатации этих приборов очень важна степень жесткости воды
Чем она меньше, тем меньше и вероятность появления накипи на тэне, и, соответственно, выхода прибора из строя. Но производители этих бытовых приборов давно уже нашли простой выход – применение химического способа смягчения воды путем добавления умягчителей в состав моющих средств
Для длительной эксплуатации этих приборов очень важна степень жесткости воды. Чем она меньше, тем меньше и вероятность появления накипи на тэне, и, соответственно, выхода прибора из строя. Но производители этих бытовых приборов давно уже нашли простой выход – применение химического способа смягчения воды путем добавления умягчителей в состав моющих средств.
Можно вспомнить о чайниках и кастрюлях, в которых кипятится вода, благополучно нами потребляемая. Но степень воздействия «жесткой» воды на наш организм досконально не изучена, чтобы говорить о каких-либо выгодах применения фильтров с ионообменными смолами.
Но давайте обсудим, на что же способны фильтры, содержащие ионообменные смолы для очистки воды. Не будем останавливаться на химических процессах, происходящих в этой жидкости, после прохождения через такой фильтр. То, что реально беспокоит потребителей, – это присутствие в воде ионов тяжелых металлов. Большинство трубопроводов в настоящее время состоит не из пластиковых труб (о которых лет 30–40 назад у нас мало кто слышал), а из металлических. Раньше при поломке одного из участков такой трубы или целой секции производили замену трубы на стальную оцинкованную.
Эти трубы до сих пор являются основным «поставщиком» ионов цинка и свинца в наш дом. Если проанализировать степень очистки воды бытовыми ионообменными фильтрами от ионов этих металлов, то окажется, что эта степень близка к нулю. По-настоящему действенные элементы, задерживающие эти вредоносные ионы, существуют, но они устанавливаются на крупных промышленных предприятиях, цель которых уловить дорогостоящие химические соединения. Из-за большой дороговизны подобного оборудования вероятность его применения в бытовых фильтрах очень низка.
Читайте материал по теме: Очистка воды от железа
Как выглядят ионообменные смолы для очистки воды
Применение ионообменных смол в фильтрующих системах частного жилого сектора давно считается необходимым условием для получения качественной питьевой воды. Пик популярности этого способа очистки приходится на конец ХХ века.
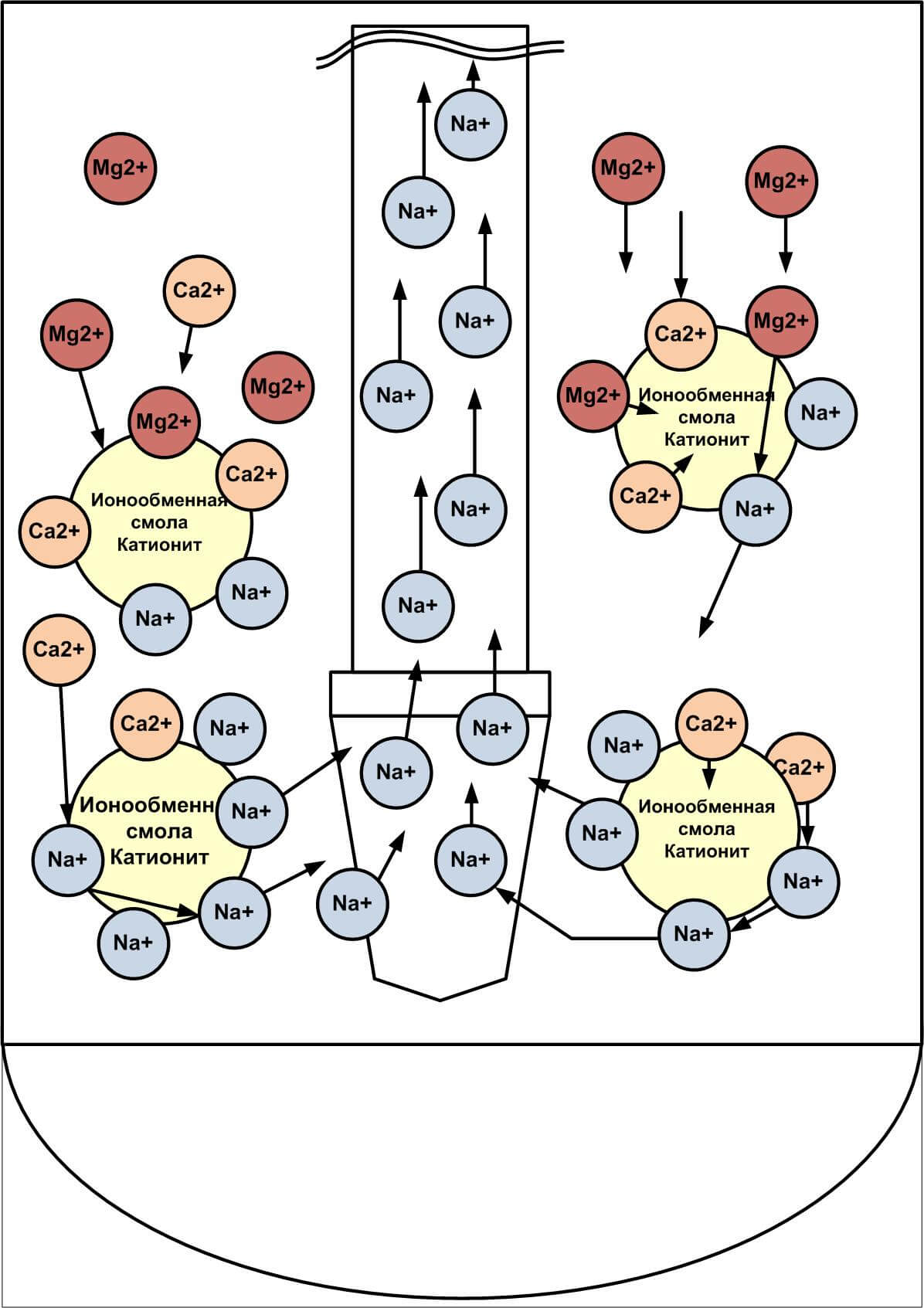
С виду, ионообменная смола – это скопление мелких шариков (до 1 мм в диаметре), которые производят из полимерных материалов.

Тот, кто никогда не сталкивался с этим материалом, с легкостью может перепутать смолу с рыбьей икрой. Пользу и его уникальные характеристики нельзя игнорировать. Использование ионообменных смол для умягчения воды позволяет задерживать ионы примесей металлов и солей жесткости. Но такой фильтр не просто накапливает в себе все эти вещества, а заменяет ионы вредных веществ на абсолютно безопасные. Эта процедура замены ионов и закрепила существующее название фильтрующей среды (ионообменные смолы).
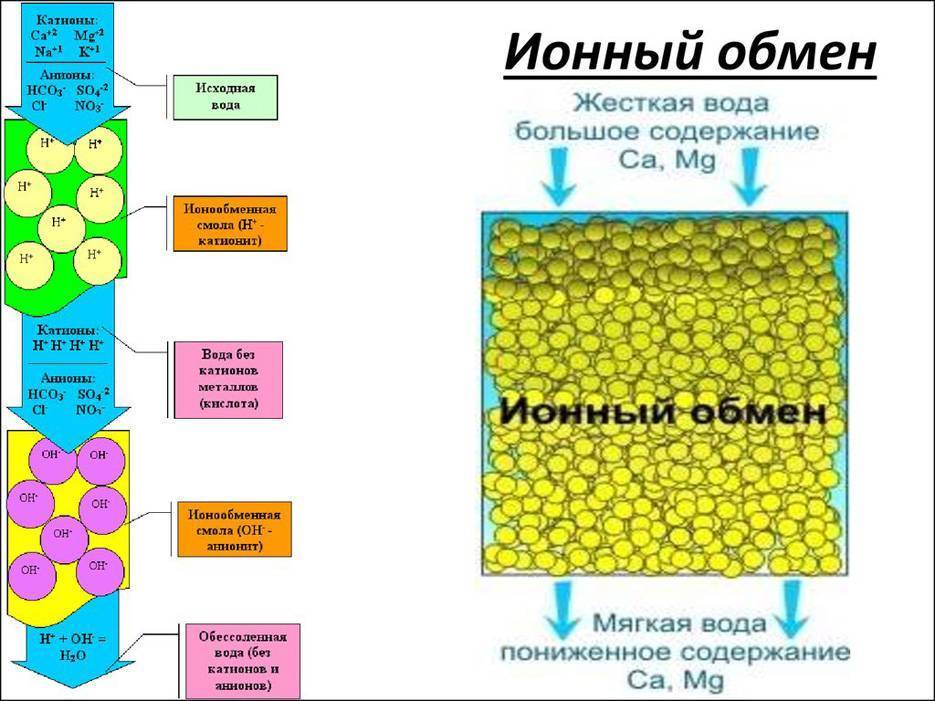
В химии ионообменные смолы относят к ионитам (высокомолекулярное соединение, имеющее функциональные группы, которые, в свою очередь, способны вступать в реакцию обмена с ионами какой-либо жидкости). Отдельные группы ионитов способны также вступать в окислительные реакции, процессы восстановления и физической сорбции.
Статьи, рекомендуемые к прочтению:
По своей структуре ионообменные смолы бывают пористыми, гелевыми или промежуточными.
Смолы с гелевой структурой не содержат пор. Обмен ионами в такой структуре возможен лишь в тот момент, когда смола набухает и становится похожей (по консистенции) на гель.
Пористая структура получила свое название благодаря огромному количеству пор на поверхности смолы. Эти поры как раз и позволяют произвести ионный обмен.
В промежуточной структуре ионообменных смол соединены свойства как пористой, так и гелевой структуры.
Все эти разновидности смол имеют принципиальные различия. У гелевых – наибольшая обменная емкость, тогда как смолы с пористой структурой обладают высокой стойкостью к химическим и термическим воздействиям. Такая стойкость позволяет смолам с пористой структурой поглощать больше примесей независимо от температуры воды.
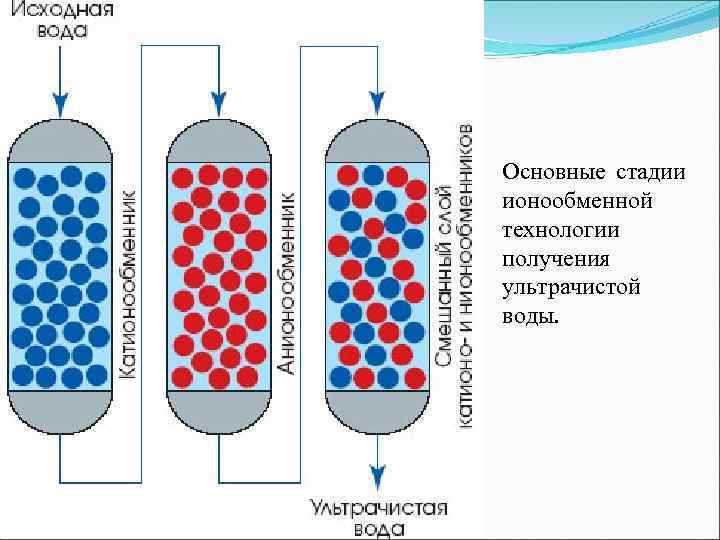
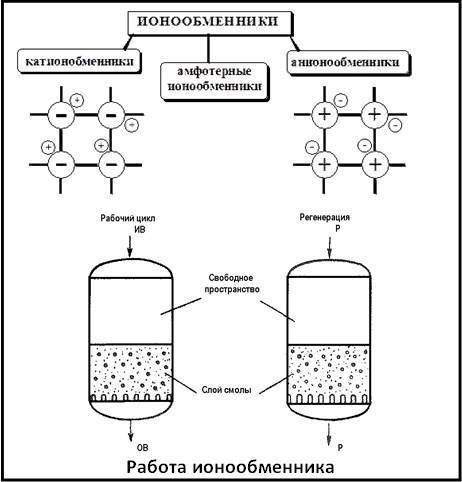
Кроме этого, ионообменные смолы для очистки воды разделяют по заряду ионов. При обмене катионов (положительно заряженных ионов) смолу называют катионитом. В случае обмена анионами (отрицательно заряженными ионами) – анионитами. На практике суть различия по этому признаку сводится к способности обмена ионов в водной среде с разным уровнем pH. У анионитов «рабочей» считается среда с рН от 1 до 6, в то время как у катионитов процессы протекают в среде с рН от 7 и более. Конечно же, пользователям необязательно разбираться в таких тонкостях работы фильтров. В выборе необходимого типа фильтрующего устройства вам должны помогать специалисты в этой области.
В большинстве случаев ионообменная смола, находящаяся в фильтрующих системах, содержит большое количество ионов солей хлора или натрия. В некоторых случаях такая смола состоит из смеси солей с другими элементами (натрий-водород, гидроксил-хлорид и др.).
В зависимости от параметров, ионообменные смолы для умягчения воды могут отличаться друг от друга. Одним из таких показателей является влажность. Оптимально, когда влажность сведена к минимуму. Поэтому производители стараются извлечь влагу из смолы еще до момента ее упаковки. Для этого используют специальные центрифуги.
Ионообменные смолы оценивают также по уровню их емкости. Эта характеристика показывает, сколько ионов в исходной среде приходится на единицу массы (объема смолы). Сравнивая смолы по этому признаку, выделяют три вида емкости: рабочую, объемную и весовую. Объемная, как и весовая, являются стандартными величинами, то есть их параметры определяют в лаборатории, а полученные данные записывают в характеристики готовых продуктов.
В отличие от двух предыдущих, рабочая емкость не подлежит измерениям, поскольку имеет много условностей (степень чистоты воды, толщина слоя смолы, сила потока воды и др.). Со временем ионы рабочей среды полностью заменяются ионами примесей, содержащихся в воде. В таком случае рабочая емкость подлежит восстановлению.
Читайте материал по теме: Обессоливание воды
Катионит. Характеристика и применение
Катиониты – это высокомолекулярные нерастворимые вещества, состоящие из твердой основы в виде небольших гранул. Они бывают минеральные и органические, искусственного и естественного происхождения.
В искусственных содержится водород, который способен замещаться другими катионами – четвертичные амины.
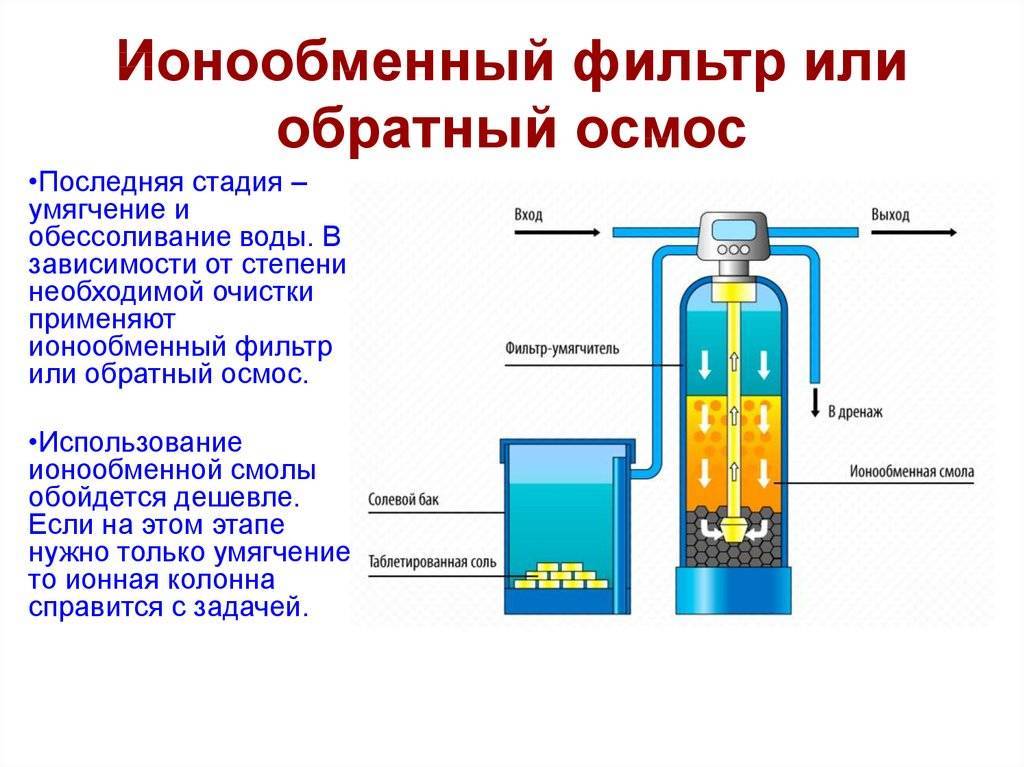
Натрий катионитовый фильтр: принцип работы и применение
Состоит он из гелиевой смолы, состоящей из натриевых шариков. Таким наполнителем заполняется картридж, и он удерживает вредные минералы. Между натрием и солями происходит бурная реакция, способствующая образованию корки. Магний с кальцием прилипает к катиониту, словно магнит.
Работа делится на 4 этапа:
- Умягчающий этап.
- Перетряска катионовой засыпки.
- Регенерация.
- Этап отмывания.
Применяется на водоподготовительных установках электростанций, промышленных и отопительных котельных.
Особенности замены и регенерации катионитовых фильтров
Регенерация катионита осуществляется последовательным пропусканием раствора кислоты серной нарастающей концентрации: 1% раствор в течение 50 минут, 1,5% раствор – 25 минут и 3% раствор пропустить 20 минут со сбрасыванием использованного раствора в бак стоков.
Следующий этап – отмывка катионита от продуктов регенерации и избыточного содержания серной кислоты.
Классификация
По структуре делятся на:1. Гелевую матрицу. Например, у гелевого каркаса иониты активизируются, если набухают, и при этом увеличиваются в объеме до трех раз. Но следует знать, что эти иониты теряют свою способность смягчать воду, когда уничтожаются сшивки.Наподобие того, как раскрывается цветочный бутон, происходит раскрытие гранул гелевой основы, что вызывает увеличение ионитов
Если обратить внимание на структуру такой основы, то можно заметить ее неоднородность. У гелевых смол есть существенный недостаток: они не могут впитывать крупные органические вещества и ионы
Это может вызвать закупорку пор смолы (иначе это явление называют «отравлением смолы»).2. Макропористую матрицу (на поверхности такой смолы присутствует большое количество пор; это позволяет повысить качество умягчения воды).Макропористые иониты на данный момент применяются чаще всего. Это может быть обусловлено следующими их преимуществами:
- Слабо изменяется объем;
- Способны хорошо абсорбировать;
- Обменные реакции продолжительны;
- Ускоренная фильтрация;
- Прочность;
- Жесткость.
Также существует дифференциация ионообменных смол, исходя из размера частиц для поглощения:
- Полидисперсные (их размер от 0,3 до 1,2 мм);
- Монодисперсные (около 0,5 мм).
Производители
Наибольшей популярностью пользуются 3 следующие компании:
- Аквафор;
- Барьер;
- Гейзер.
Аквафор
Российская компания из Санкт-Петербурга, с 1992 года специализирующаяся на производстве фильтров для жидкости и сорбентов.
Особенности продукции:
- В кувшинных моделях используются электронные датчики заполнения и контроля над картриджем.
- В магистральные и проточные устройства встроено волокно Аквален. Оно позволяет добиваться стабильные результатов очищения долгий период.
- Фильтры с опцией WaterBoss. Это устройства с автоматическим контролем и очищением.
- Эффективно блокируют механические примеси и борются с бактериями.
Барьер
Российская компания с 1993 года выпускающая фильтры бытового назначения. Имеет 4 производственные точки в крупных городах.
Особенности фильтров:
- Выпуск собственной ионообменной смолы.
- Уникальное механическое очищение – опция для кувшинных моделей.
- Высокая надёжность и долговечность.
- Очень аккуратная упаковка для каждой модели.
Гейзер
 Производитель бытовых установок с широким ассортиментом.
Производитель бытовых установок с широким ассортиментом.
Особенности продукции с ионным обменом:
- Пропускной потенциал до 3 л в минуту для некоторых моделей.
- Наличие установок с системой связывания солей. Они эффективно фильтруют жёсткие осадки.
- Применение полифосфатов в фильтровальных блоках.
2.1 Умягчение воды кипячением
Кипячение (термический метод умягчения) – процесс нагревания воды, в результате которого устраняется временная жесткость, т.е. удаляются гидрокарбонаты кальция и магния, осаждающиеся в виде белой накипи. Таким образом, вода становится более мягкой.
Соли жесткости имеют свойство терять растворимость с ростом температуры. То есть, чем температура нагревания выше, тем быстрее образуются отложения. Чем дольше продолжается процесс кипячения, тем больше солей выпадет в осадок, и тем мягче будет полученная вода.
При использовании кипячения с целью понизить жесткость воды, учитываются несколько моментов.
Необходимо определить оптимальное положение крышки на емкости. Желательно, чтобы выделяющийся в процессе углекислый газ как можно быстрее улетучивался, поэтому рекомендуется не полностью закрывать крышку емкости, где происходит кипячение. При плотно закрытой крышке свободное улетучивание углекислого газа затруднено, и следовательно выпадение солей жесткости в осадок происходит медленнее. Если же емкость полностью открыта, вода быстро испаряется, и общее количество солей растет, ухудшая тем самым вкус воды.
Следующий момент, чем больше содержится в воде солей магния и кальция, тем быстрее в процессе нагревания будет образовываться накипь. Таким образом, необходимо знать уровень жесткости очищаемой воды. Например, если жесткость воды менее 4 мг-экв/л, то умягчать ее кипячением не имеет смысла. Реакция термического осаждения в этом случае будет слишком медленной, и испарится большое количество воды. Это в свою очередь негативно повлияет на вкус воды, так как концентрация солей будет неоптимальной.
Еще один параметр влияющий на время, необходимое, чтобы выпали в осадок все соли жесткости, это площадь поверхности, на которой будет происходить осаждение, т.е. площадь стенок и дна, контактирующих с водой. Чем площадь больше, тем эффективнее будет идти процесс, и тем меньше времени он займет. Причем, эффективность будет расти также с увеличение слоя накипи на поверхности емкости.
В бытовых, домашних условиях результат этого метода можно проверить либо просто на вкус, либо с помощью специального устройства.
С целью определения точного времени, необходимого на термическое умягчение воды, применяют прибор TDS-метр, или солемер. Устройство измеряет общее количество солей в воде (в том числе учитываются соли жесткости). Таким образом, если в процессе кипячения произошло выпадение осадка, то прибор покажет меньшее количество содержания солей. Вместе с тем, можно также определить, когда термическое воздействие уже не убирает временную жесткость, а наоборот повышает общее количество солей из-за испаряющейся воды.
Рекомендуется использовать солемер с температурным компенсатором, тогда показания прибора по содержанию солей будут корректны при разных температурах нагреваемой воды.
Регенерация
Нужно взять поваренную соль без каких-либо добавок и
приготовить 30% раствор. Например, в 1 литр добавить стакан соли. Тут точность
особо не важна. Соль должна полностью раствориться, поэтому можно использовать
теплую воду, которую потом остудить до комнатной температуры.
А вот сколько выдерживать в такой воде, тут мнения
разделяются.
 Из инструкции Гейзер
Из инструкции Гейзер Из инструкции Аквафор Трио
Из инструкции Аквафор Трио Из инструкции Аквафор Кристалл
Из инструкции Аквафор Кристалл
Я рекомендую оставить это дело восстанавливаться с вечера до утра – вся емкость смолы должна вернуться.
Регенерация для самых жадных
Если картридж со смолой используется долго и пережил
несколько регенераций солевым раствором. Если вы чувствуете, что как-то он не
очень работает, и уже через неделю опять появляется накипь в чайнике. То все
это говорит о том, что он хочет на покой. Но мы его так просто не отпустим.
Гипотетически гранулы могут покрыться налетом,
препятствующим нормальному протеканию восстановительных процессов. Соответственно
его нужно чем-то растворить. Будем использовать слабую кислоту.
В 1,5 литрах теплой воды растворите 50 г лимонной кислоты. Оставьте на время, чтобы температура опустилась до комнатной. Этим раствором необходимо залить смолу на 2-3 часа и оставить в покое. Потом промыть чистой водой и попробовать восстановить солевым раствором, как обычно.
Срок службы
Средний срок службы в зависимости от интенсивности
использования фильтрующего материала составляет 3-5 лет. Это объясняется
механическим истиранием гранул, постепенным вымыванием мелких частиц
ионообменной смолы. При неправильной эксплуатации она может испортиться и на
первом году, в идеальных условиях – прослужит до 10 лет.
Вред
Можно ли пить воду после ее очистки ионообменными смолами? Если говорить про обычные бытовые случаи умягчения жесткой воды, то можно, ведь именно для этого эти смолы и производят. Другое дело, что количество натрия в питьевой воде регламентируется тем же СанПиН 2.1.4.1074-01. По этим нормам натрий в воде относится ко 2-му классу опасности, т.е. это высокоопасное вещество.
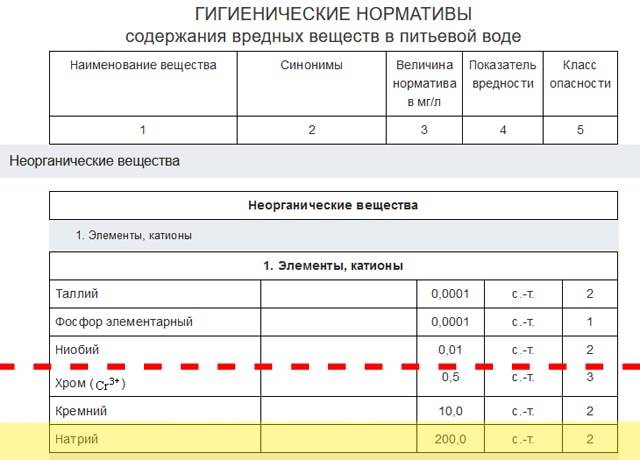
Какие-то соли натрия есть в исходной воде, а если учесть и
те, которые будут поступать из смолы в процессе умягчения воды, то можно
предположить следующее:
Если умягчать очень жесткую воду (жесткость от 7 мг*экв/л и
выше) таким способом, то натрия там будет реально много. Сколько именно? А
давайте посчитаем!
Для упрощения предположим, что жесткость обусловлена только
присутствием солей кальция. Обычно их больше, чем соединений магния, так что
все нормально.
1 мг-экв/л = 20,04 мг/л Ca2+
У нас жесткость 7 и выше, принимаем равной 7.
Получается, что в этом случае в 1 л. воды будет содержаться
около 140 мг солей кальция.
Считаем, сколько это моль: 0,14/40=0,0035 моль
Учитывая валентность, на обмен поступит в 2 раза большее
количество натрия или 0,007 моль.
Считаем массу ионов натрия: 0,007*23=0,161 г или 161 мг.
Т.е. при верхнем пороге жесткости по действующему СанПиН количество
натрия лишь приблизится к максимально допустимому его содержанию. Здоровые люди
могут быть спокойны.
В то же время переизбыток солей натрия способен вызывать
отеки вследствие задержки жидкости, вызывает повышение давления, провоцирует
заболевания почек, печени, желудка, поджелудочной.
Неспроста есть такое понятие как гиперумягчение воды, с
которым борются установкой байпаса, когда часть жидкости идет в обход ионообменного
материала и только потом смешивается с умягченной.
Другие физико-химические методы очистки воды
Все физико-химические способы очистки воды направлены на удаление растворенных в ней примесей, а в ряде случаев и взвешенных частиц. Многие методики физико-химической очистки также требуют глубокого предварительного выделения из стоков взвешенных включений, для чего применяется процесс коагуляции. Основные методики физико-химической очистки воды:
- флотация;
- сорбция;
- электрохимическая и ионообменная очистка;
- нейтрализация;
- гиперфильтрация;
- экстракция;
- эвапорация;
- выпаривание, испарение, кристаллизация.
При этом самым востребованным способом является именно метод флотации, направленный на извлечение из водных масс нефтепродуктов и других гидрофобных частиц с помощью газовых пузырьков. В основе процесса очистки лежит молекулярное слипание частичек масла и пузырьков тонкодиспергированного газа. Образование пузырьков зависит от интенсивности их столкновения, а также химического взаимодействия веществ в воде, избыточного давления газа, прочих факторов.